-地尼法司他(denifanstat,ASC40)达到所有主要、关键次要及次要疗效终点(意向治疗集(ITT)分析),与安慰剂相比显著改善中重度痤疮。
-地尼法司他(ASC40)显示出了良好的安全性与耐受性特征。地尼法司他(ASC40)组和安慰剂组的治疗期间发生的不良事件(TEAE)发生率相当:58.6%对比56.3%。大部分TEAE为轻度(1级)或中度(2级)。
-歌礼正与中国国家药品监督管理局(NMPA)进行地尼法司他(ASC40)的上市申请前(Pre-NDA)沟通,NMPA目前反馈良好。歌礼计划在完成上市申请前沟通后向NMPA提交地尼法司他(ASC40)用于治疗中重度寻常性痤疮的新药上市申请(NDA)。
香港,2025年9月18日--歌礼制药有限公司(香港联交所代码:1672,简称“歌礼”)今日宣布,在2025年9月17日于法国巴黎举行的2025年欧洲皮肤病与性病学会(EADV)年会最新突破性研究专场上口头报告了地尼法司他(denifanstat,ASC40)治疗中重度寻常性痤疮的III期研究(NCT06192264)结果。
口头报告细节
标题:同类首创脂肪酸合成酶(FASN)抑制剂地尼法司他治疗寻常性痤疮达到所有终点:一项III期随机、安慰剂对照试验的结果
报告人:项蕾红博士,地尼法司他(ASC40)III期研究主要研究者,复旦大学附属华山医院皮肤科
该项III期临床试验是一项在中国开展的随机、双盲、安慰剂对照、多中心的临床试验,旨在评估地尼法司他(ASC40)每日一次口服片在480例中重度寻常性痤疮患者中的安全性和疗效。患者被按照1:1的比例入组并随机分至一个活性药物组和一个安慰剂对照组,接受每日一次50毫克地尼法司他(ASC40)口服片或匹配的安慰剂治疗,为期12周。地尼法司他(ASC40)组和安慰剂组基线特征均衡。
主要终点包括治疗成功百分比(治疗成功的定义为在第12周时,研究者总体评估(Investigator's Global Assessment,IGA)评分较基线下降至少2分,且IGA分级为0分(光洁)或1分(几乎光洁))、第12周时总皮损计数(TLC)相对基线百分比下降,以及第12周时炎性皮损计数(ILC)相对基线百分比下降。
治疗4周后,地尼法司他(ASC40)治疗组已在多项疗效终点上均显示出较安慰剂组具有统计学意义的显著改善(p<0.05),包括治疗成功、TLC、ILC及非炎性皮损计数(NILC)。
治疗12周后,地尼法司他(ASC40)达到所有主要、关键次要及次要疗效终点。表1总结了III期研究对比安慰剂的疗效结果(意向治疗集(ITT)分析)。
表1. III期研究对比安慰剂的疗效结果(意向治疗集(ITT)分析)
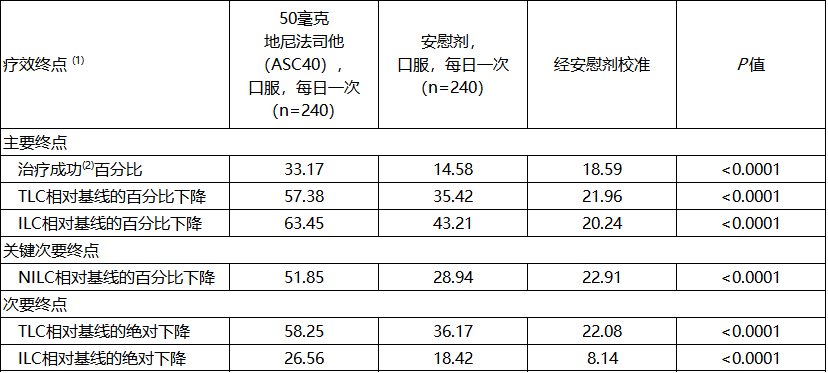
注释:
(1)所有疗效终点均为最小二乘均值。
(2)治疗成功的定义为在第12周时,研究者总体评估(Investigator's Global Assessment,IGA)评分较基线下降至少2分,且IGA分级为0分(光洁)或1分(几乎光洁)。
(3)TLC:总皮损计数;ILC:炎性皮损计数;NILC:非炎性皮损计数。
每日一次口服50毫克地尼法司他(ASC40),为期12周的安全性和耐受性特征良好。地尼法司他(ASC40)治疗组和安慰剂组的治疗期间发生的不良事件(treatment-emergent adverse events,TEAE)发生率相当:58.6%对比56.3%。任何类别的与试验药物相关的TEAE发生率均不超过10%。仅两类TEAE的发生率超过5%(皮肤干燥在地尼法司他(ASC40)治疗组和安慰剂组的发生率分别为6.3%和2.9%,干眼症在地尼法司他(ASC40)治疗组和安慰剂组的发生率分别为5.9%和3.8%)。大部分TEAE为轻度(1级)或中度(2级)。所有与地尼法司他(ASC40)相关的TEAE均为轻度(1级)或中度(2级)。没有与地尼法司他(ASC40)相关的3级或4级TEAE,且没有与地尼法司他(ASC40)相关的严重不良事件(SAE)。未有报告死亡病例。未观察到与地尼法司他(ASC40)相关的永久性终止治疗或退出试验的情况。
在2025年EADV年会上报告的详细数据见歌礼网站(链接)。
“地尼法司他(ASC40)是痤疮治疗领域的创新性疗法,具有潜在的临床重要意义。我们非常荣幸能在本届EADV年会上向皮肤病学界展示这些结果。”歌礼创始人、董事会主席兼首席执行官吴劲梓博士表示,“地尼法司他(ASC40)采用痤疮治疗新作用机制,在III期研究中所有主要和次要终点较安慰剂均显示出高度具有统计学意义且临床意义显著的改善,同时显示出良好的安全性和耐受性特征。”
歌礼正与中国国家药品监督管理局(NMPA)进行地尼法司他(ASC40)的上市申请前(Pre-NDA)沟通,NMPA目前反馈良好。歌礼计划在完成上市申请前沟通后向NMPA提交地尼法司他(ASC40)用于治疗中重度寻常性痤疮的新药上市申请(NDA)。
歌礼已从Sagimet Biosciences Inc.(纳斯达克股票代码:SGMT)获得地尼法司他(ASC40)的大中华区独家授权。
关于歌礼制药有限公司
歌礼制药有限公司是一家全价值链整合型生物技术公司,聚焦有望成为治疗代谢疾病同类最佳(best-in-class)和同类首创(first-in-class)药物的开发和商业化。利用公司专有的基于结构的AI辅助药物发现(Artificial Intelligence-Assisted Structure-Based Drug Discovery,AISBDD)平台和超长效药物开发平台(Ultra-Long-Acting Platform,ULAP),歌礼已自主研发多款候选药物,包括其核心项目:ASC30,一款在研小分子GLP-1受体(GLP-1R)激动剂,既可每日一次口服也可每月一次至每季度一次皮下注射作为减重治疗疗法和减重维持疗法,用于长期体重管理。歌礼已在香港联交所上市(1672.HK)。
欲了解更多信息,敬请登录网站:www.ascletis.com。
详情垂询:
Peter Vozzo
ICR Healthcare
443-231-0505 (美国)
Peter.vozzo@icrhealthcare.com
歌礼制药有限公司PR和IR团队
+86-181-0650-9129 (中国)
pr@ascletis.com
ir@ascletis.com