-ASC30每日一次口服片显示,经28天治疗后,安慰剂校准后的相对基线的平均体重下降高达6.5%。
-ASC30片更优的疗效得益于其更高的口服药物暴露量。
-ASC30安全性和耐受性良好,仅出现轻度至中度胃肠道(GI)不良事件(AE)。由于多剂量递增(MAD)队列1采用2毫克至5毫克的周递增(weekly titration)策略,该队列未发生呕吐。
香港,2025年9月17日--歌礼制药有限公司(香港联交所代码:1672,简称“歌礼”)宣布,在2025年9月16日在奥地利维也纳举行的第61届欧洲糖尿病研究协会(EASD)年会上的简短口头讨论专场会议A中报告了其ASC30口服小分子GLP-1受体(GLP-1R)激动剂28天多剂量递增(MAD)研究(NCT06680440)队列1和队列2的结果。
该Ib期MAD研究是一项在美国开展的随机、双盲、安慰剂对照的研究,旨在评估ASC30每日一次口服片在肥胖受试者(体重指数(BMI):30-40 kg/m²)中的安全性与耐受性、不同剂量递增方案、药代动力学(PK)特征及初步疗效。
在MAD队列2(2毫克、10毫克、20毫克和40毫克,每周剂量递增)中,ASC30每日一次口服片显示,经28天治疗后,安慰剂校准后的相对基线的平均体重下降6.5%。在MAD队列1(2毫克、5毫克、10毫克和20毫克,每周剂量递增)中,ASC30每日一次口服片显示,经28天治疗后,安慰剂校准后的相对基线的平均体重下降4.5%。第29天未观察到减重平台期迹象。
20毫克和40毫克ASC30在稳态时显示出更优的口服PK特征。更高的药时曲线下面积(AUC)与更显著的体重下降呈正相关。表1总结了ASC30的PK特征。
表1. ASC30的PK特征
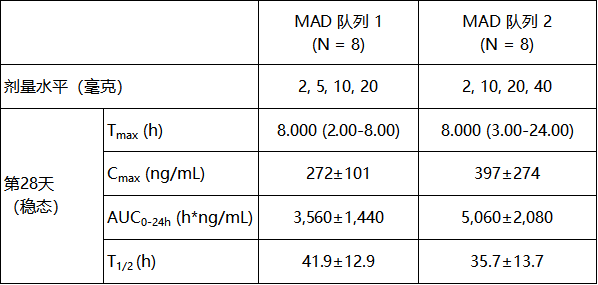
注释:PK:药代动力学;MAD:多剂量递增;Tmax:达峰时间,以中位数(范围)显示;Cmax:血药峰浓度,以平均值±标准差显示;AUC0-24h: 0-24小时药时曲线下面积,以平均值±标准差显示;T1/2:半衰期,以平均值±标准差显示。
ASC30安全性和耐受性良好,仅出现轻度至中度胃肠道(GI)不良事件(AE)。在28天治疗期及7天随访期内,MAD队列1(2毫克、5毫克、10毫克和20毫克)的呕吐发生率为零。虽然MAD队列2(2毫克、10毫克、20毫克和40毫克)发生了呕吐事件,但大部分发生于10毫克剂量递增周期间,且在2毫克剂量递增周未报告呕吐事件。综上所述,数据表明从2毫克逐周递增至5毫克是一种适宜的递增速度,并为IIa期研究设计的剂量递增方案提供了关键依据。
未有报告严重不良事件(SAE),也未观察到3级或以上AE。包括丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)和总胆红素(TBL)在内的肝酶在治疗期间均未升高。实验室检查、生命体征、ECGs(心电图,包括按心率校正的QT间期(QTc))和体格检查均未发现异常。
在第61届EASD年会上报告的详细数据见歌礼网站(链接)。
“我们非常高兴能在今年EASD年会的口头报告环节报告ASC30口服片的临床数据。”歌礼创始人、董事会主席兼首席执行官吴劲梓博士表示,“ASC30口服片已显示出优越的疗效与安全性数据,这再一次彰显了我们强大的研发能力,能为肥胖症治疗提供更具差异化的选择。我们期待在今年第四季度报告ASC30口服片13周IIa期研究的顶线结果。”
关于 ASC30
ASC30是一款正在临床研究中的小分子GLP-1R偏向激动剂,具有独特和差异化性质,使得同一小分子同时适用于口服片剂和皮下注射给药成为可能。ASC30是一种新化学实体(NCE),拥有美国和全球化合物专利保护,专利保护期至2044年(不含专利延期)。
关于歌礼制药有限公司
歌礼制药有限公司是一家全价值链整合型生物技术公司,聚焦有望成为治疗代谢疾病同类最佳(best-in-class)和同类首创(first-in-class)药物的开发和商业化。利用公司专有的基于结构的AI辅助药物发现(Artificial Intelligence-Assisted Structure-Based Drug Discovery,AISBDD)平台和超长效药物开发平台(Ultra-Long-Acting Platform,ULAP),歌礼已自主研发多款候选药物,包括其核心项目:ASC30,一款在研小分子GLP-1受体(GLP-1R)激动剂,既可每日一次口服也可每月一次至每季度一次皮下注射作为减重治疗疗法和减重维持疗法,用于长期体重管理。歌礼已在香港联交所上市(1672.HK)。
欲了解更多信息,敬请登录网站:www.ascletis.com。
详情垂询:
Peter Vozzo
ICR Healthcare
443-231-0505 (美国)
Peter.vozzo@icrhealthcare.com
歌礼制药有限公司PR和IR团队
+86-181-0650-9129 (中国)
pr@ascletis.com
ir@ascletis.com